: ส่องโลก มองไทย แผนตั้งรับนานาสายพันธุ์โควิด-19
ไม่เพียงเหตุผลเรื่องการจัดหาวัคซีนโควิด-19 มาฉีดให้ประชาชนล่าช้า หรือจัดโควตาวัคซีนตอบสนองกลุ่มการเมืองเป็นหลัก แต่เหตุผลที่ประชาชนทยอยออกมาสร้างแรงกดดันต่อรัฐบาล พล.อ. ประยุทธ์ จันทร์โอชา ยังเป็นเพราะวัคซีนที่จัดหามานั้น ไม่มีประสิทธิผลเพียงพอต่อต้านไวรัสกลายพันธุ์
ประเทศไทย เดินทางมาถึงจุดที่มีผู้เสียชีวิตเฉลี่ยเกือบร้อยคนต่อวัน และมีผู้ติดเชื้อรายวันไม่ต่ำกว่า 7,000 คน ต่อเนื่องหลายสัปดาห์ มีผู้ป่วยโควิด-19 ครองเตียงนับแสนรายทั่วประเทศ
แพทย์จากชนบทต้องยกทีมมาช่วยคัดกรองผู้ป่วยกลางกรุง รวมทั้งการเกิดเครือข่าย “หมอไม่ทน” ที่ร่วมกับภาคประชาชนเรียกร้องให้ภาครัฐจัดหาวัคซีนโควิด-19 ชนิด mRNA เข้ามาให้บุคลากรทางการแพทย์ด่านหน้า เพราะหากติดโควิด-19 ไปมาก ๆ จะไม่มีคนรักษา
ไม่ใช่แค่ผู้ป่วยโควิด -19 เท่านั้น ยังรวมถึงโรคอื่น ๆ ด้วย ซึ่งส่งผลกระทบเป็นลูกโซ่ อาจทำให้ระบบสาธารณสุขของประเทศล่ม
เมื่อถึงจุดนั้น โอกาสในการเปิดประเทศก็น้อยลง…
เรากำลังสู้กับ ‘ไวรัส’ สิ่งมีชีวิตที่ปรับเปลี่ยนตัวเองให้มีชีวิตรอด ซึ่งลักษณะเฉพาะของโคโรนาไวรัส 2019 ที่มีหนามแหลมคมรอบตัว ทำให้โอกาสในการกลายพันธุ์เกิดขึ้นแทบไม่รู้จบ
สำหรับประเทศไทย การระบาดระลอกสาม ตั้งแต่เดือนเมษายน 2564 นักไวรัสวิทยากังวลมาก เพราะโคโรนาไวรัส 2019 สายพันธุ์อัลฟา (อังกฤษ) มีลักษณะพิเศษ คือ ติดเชื้อง่ายกว่าสายพันธุ์ปกติประมาณ 1.7 เท่า ทำให้ผู้ติดเชื้อพุ่งจากหลักร้อยขึ้นเป็นหลักพัน และไม่เคยลงต่ำอีกแล้ว
จากนั้น สามเดือนต่อมา ไทยเข้าสู่การระบาดระลอกที่สี่ ด้วยโคโรนาไวรัส 2019 สายพันธุ์เดลตา (อินเดีย) ซึ่งมีความสามารถในการแพร่เชื้อสูงขึ้น หลบเลี่ยงภูมิคุ้มกันจากวัคซีนต่าง ๆ ได้
ที่สำคัญทำให้เชื้อลงปอดเร็ว นี่เป็นสาเหตุทำให้ผู้ป่วยโควิด-19 ระยะหลังต้องเข้าไอซียูและใส่ท่อช่วยหายใจมากขึ้น แนวโน้มการขาดแคลนถังออกซิเจนค่อย ๆ ปรากฏให้เห็น
สถานการณ์วิกฤตจากเชื้อกลายพันธุ์เช่นนี้ ทำให้สังคมไทยตั้งคำถามหาวัคซีนที่รับมือกับเชื้อกลายพันธุ์ได้มากขึ้น
ในสงครามที่ไทย แทบไม่มีอาวุธหรือยุทธศาสตร์การรบให้ประชาชนมีความหวังเลย…
แต่หากไทยเรียนรู้จากบทเรียนการตั้งรับ “ไวรัสกลายพันธุ์” จากนานาชาติ โดยเฉพาะเครื่องมือหลักที่ทั่วโลกเลือกใช้อย่าง “วัคซีน” ก็น่าจะทำให้เรารับมือกับมันได้อย่างมีประสิทธิภาพ…มากกว่าที่เป็นอยู่
The Active ชวนทำความเข้าใจข้อมูลอันซับซ้อนที่มีผลต่อเนื่องกันอย่างน่าสนใจ ระหว่างการกลายพันธุ์ของไวรัส และวัคซีนที่จะช่วยรับมือ รวมถึงมาตรการควบคุมโรค ซึ่งเป็นส่วนประกอบสำคัญ ที่จะช่วยทำให้ 14 วัน (หรือมากกว่านั้น) ของการล็อกดาวน์ในพื้นที่ระบาดสูง ไม่สูญเปล่า
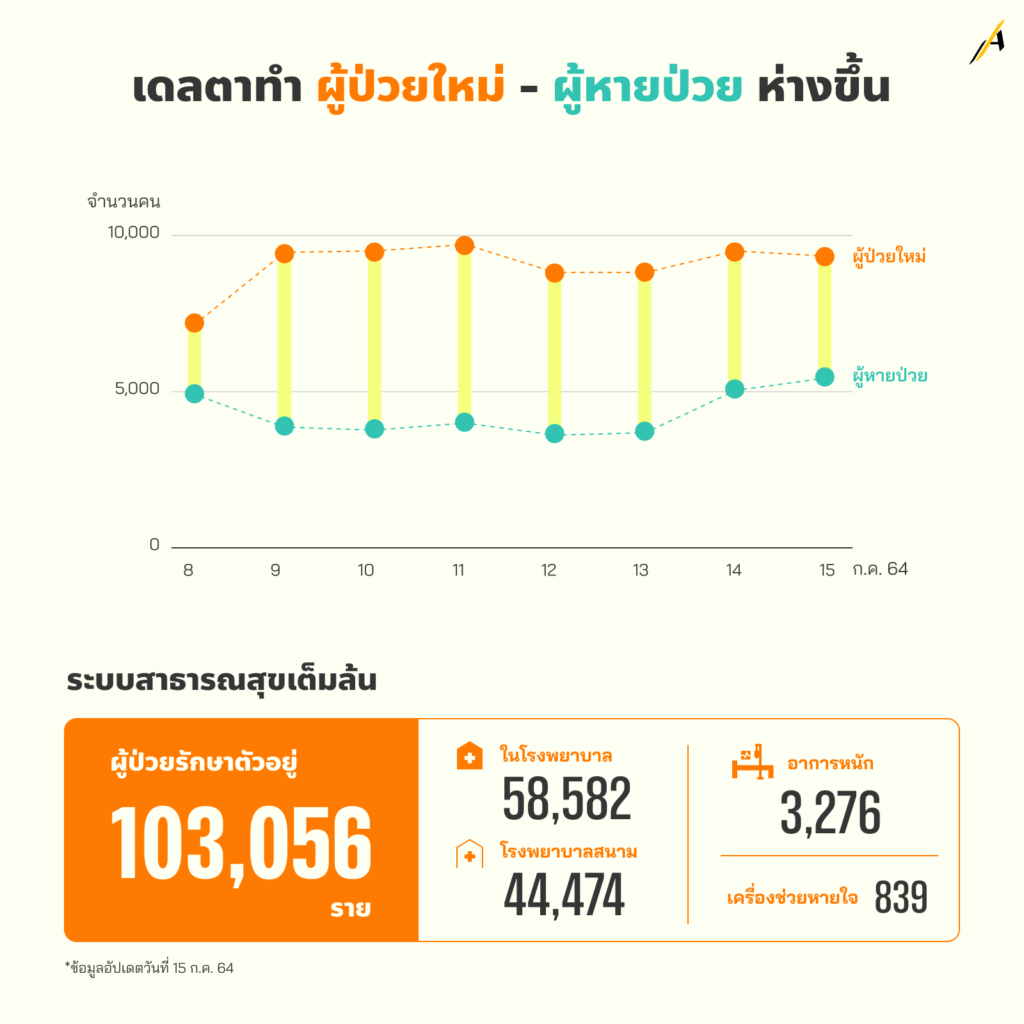
“เดลตา” ทำผู้ป่วยใหม่ – คนหายป่วย ห่างขึ้นทุกที
การศึกษาทั่วโลกชี้ให้เห็นว่า การใช้วัคซีนที่มีความจำเพาะกับโคโรนาไวรัส 2019 เช่น ฝึกให้ภูมิคุ้มกันจดจำหนามรอบตัวไวรัสลักษณะใดลักษณะหนึ่ง ดังที่วัคซีนแบบ mRNA หรือแบบ Viral vector จำนวนมากใช้กัน จะสร้างแรงกดดันต่อไวรัสที่เหลือรอด จนอาจทำให้ไวรัสมีวิวัฒนาการกลายเป็นสายพันธุ์ใหม่ไปเรื่อย ๆ สามารถหลบหลีกภูมิคุ้มกันที่สร้างโดยวัคซีนที่มีลักษณะจำเพาะเหล่านั้น
cov-lineages.org เว็บไซต์ที่นักวิจัยและหน่วยงานด้านสาธารณสุขทั่วโลกใช้ติดตามการแพร่กระจายของ SARS-CoV-2 หรือเชื้อโคโรนาไวรัส 2019 เปิดเผยข้อมูลเมื่อ 12 ก.ค. 2564 ว่า นับตั้งแต่ปลายปี 2563 ซึ่งเป็นจุดเริ่มต้นของการพบการระบาด จนถึงเวลานี้ ทั่วโลกมีสายพันธุ์ของโคโรนาไวรัส ที่ทำให้เกิดการระบาดโควิด- 19 มากถึง 1,302 สายพันธุ์
นอกจากปัจจัยเรื่องไวรัสสามารถทำสำเนาจีโนมของตัวเองออกมาในรูปของ messenger RNA ได้ อีกปัจจัยสำคัญที่มีการคาดการณ์ว่า ช่วยกระตุ้นให้ไวรัสกลายพันธุ์ได้ก็คือ “วัคซีน” บางชนิด
นั่นทำให้ การกลายพันธุ์และการเข้าชุดยีนใหม่ในกระบวนการติดเชื้อระดับเซลล์ของโคโรนาไวรัส ทำให้เกิด “ไวรัสผันแปรทางพันธุกรรม” (Variant) จำนวนมาก
ศ. นพ.อุดม คชินทร ที่ปรึกษา ศบค. ระบุในการแถลงข่าวสถานการณ์การระบาดของโควิด-19 เมื่อ 6 ก.ค. 2564 ว่า ไทยเข้าสู่การระบาดระลอก 4 อย่างเป็นทางการ เพราะเป็นไวรัสตัวใหม่สายพันธุ์เดลตา (อินเดีย) ทำให้มีการแพร่ระบาดในชุมชน ครอบครัว องค์กร จนหาที่มาที่ไปไม่ได้
15 ก.ค. 2564 เป็นวันแรกที่ประเทศไทยมีผู้ป่วยติดเชื้อที่อยู่ระหว่างการรักษาพร้อม ๆ กัน แตะหลักแสนคน ในจำนวนนี้ ใช้ทรัพยากรหลักภายในโรงพยาบาล ที่ส่วนใหญ่เป็นผู้ป่วยแสดงอาการ มากถึง 58,582 คน
ส่วนผู้ติดเชื้อรายใหม่ ประเทศไทยไม่เคยต่ำกว่าวันละ 7,000 คน มาตั้งแต่วันที่ 8 ก.ค.
เช่นเดียวกัน ในวันที่มีผู้ป่วยกำลังรักษาตัวที่หลักแสนคน เรามีผู้ป่วยใหม่ 9,186 คน
ตัวเลขนี้สำคัญอย่างไรระบบสาธารณสุข? นั่นเพราะหากเทียบกับจำนวนผู้ป่วยที่รักษาหาย ในวันเดียวกัน มีเพียง 5,543 คน ยังไม่นับผู้ติดเชื้อที่ไม่มีโอกาสถูกนับรวมในตัวเลขนี้ เพราะเสียชีวิตเกือบหนึ่งร้อยคน ทำให้ตัวเลขของผู้ป่วยใหม่และผู้รักษาหาย “ขยายห่างกันมากขึ้น” ทุกที
14 วัน แห่งความหวัง ทางรอดประเทศไทย?

รัฐประกาศมาตรการควบคุมโรค ตาม พ.ร.ก.ฉุกเฉินฯ ฉบับที่ 25 ให้ปิดแคมป์ก่อสร้างในพื้นที่กรุงเทพฯ ปริมณฑล และ 4 จังหวัดภาคใต้ เมื่อ 29 มิ.ย. 2564 เป็นจุดเปลี่ยนสถานการณ์ให้คนงานและแรงงานข้ามชาติจากแคมป์ก่อสร้างต่าง ๆ เดินทางกระจัดกระจายไปทั่วประเทศ ยิ่งทำให้เชื้อสายพันธุ์เดลตากระจายไปทั่วประเทศเร็วขึ้นอย่างคาดไม่ถึง
8 ก.ค. เป็นวันสุดท้ายที่ประเทศไทยมีผู้ติดเชื้อรายวัน 7,000 คน หลังจากวันนั้น หลายคนประเมินว่า เรามีผู้ติดเชื้อรายวันมากกว่าหมื่นคน เพราะมีคนเข้าไม่ถึงการตรวจคัดกรอง และผู้ป่วยตกค้างอยู่ในชุมชนเป็นจำนวนมาก
นั่นทำให้ 10 ก.ค. 2564 ศบค. ตัดสินใจออกประกาศฉบับที่ 27 ล็อกดาวน์ 10 จังหวัด พื้นที่ควบคุมสูงสุดและเข้มงวด หรือจังหวัด ‘สีแดงเข้ม’ หลายส่วนที่ได้รับผลกระทบ เพื่อให้ผู้คนหยุดเดินทางและอยู่ในเคหะสถานมากที่สุด หรือนัยเพื่อลดการแพร่กระจายเชื้อ แต่ผู้คนก็ยิ่งสงสัยมากขึ้นว่าการล็อกดาวน์นี้จะกดเส้นกราฟให้ต่ำลงมาได้อย่างไร
หลายคนได้แต่ภาวนาว่ามาตรการควบคุมโรคที่เข้มงวดใน 14 วันหลังจากนั้น จะต้องไม่สูญเปล่า
สำรวจอย่างเร็ว ๆ มี 3 ยุทธศาสตร์ที่ต้องทำในช่วงล็อกดาวน์นี้ให้เป็นผล คือ ตรวจเชื้อให้เร็ว รักษาชีวิตให้ทัน และเร่งสร้างภูมิคุ้มกัน
ตรวจเชื้อให้เร็ว
การแพร่ระบาดอย่างรวดเร็วและส่งผลให้ความรุนแรงของอาการติดเชื้อเพิ่มขึ้น กรุงเทพมหานคร นอกจากจะเป็นการปกครองท้องถิ่นรูปแบบพิเศษแล้ว ยังเป็นเมืองหลวงของโควิด-19
ภาพคนค้างคืนต่อคิวเพื่อขอตรวจเชื้อ ถูกเผยแพร่ไปทั่วโลก วันที่ 12 ก.ค. คณะกรรมการโรคติดต่อแห่งชาติ จึงมีมติ “คลายล็อกการตรวจหาเชื้อ” ยอมให้ใช้ การตรวจหาเชื้อแบบ Rapid Antigen Test เป็นอีกวิธีเพื่อแยกผู้ป่วยกับผู้สัมผัสเสี่ยงสูงให้เร็วขึ้น ควบคุมโรคได้มากขึ้น รวมถึงการออกนโยบายให้ประชาชนสามารถเข้าถึงชุดตรวจด้วยตนเอง ตามมาตรฐานที่สำนักงานคณะกรรมการอาหารและยา (อย.) กำหนด
ทั้งนี้ ข้อมูลจากกรมวิทยาศาสตร์การแพทย์ ณ วันที่ 10 ก.ค. 2564 เปิดเผยข้อมูลการตรวจหาเชื้อว่า จากการตรวจหาเชื้อวันละราว 60,000 ตัวอย่างนั้น พบผู้ติดเชื้อเฉลี่ยวันละ 6,209 ตัวอย่าง นั่นหมายความว่า เราพบผู้ติดเชื้อจากการตรวจถึง 9.8%
แน่นอนว่า ตัวเลขนี้ ไม่ได้นับเอาผลการตรวจหาเชื้อด้วยตัวเองเข้าไปด้วย
- อ่านเพิ่ม เปิดช่องทางผู้ป่วยโควิด-19 สีเขียวรักษาตัวที่บ้าน ผ่านสายด่วน สปสช. 1330 – แอดไลน์ @comcovid-19
- อ่านเพิ่ม มติ คกก.โรคติดต่อแห่งชาติ ปรับสูตรวัคซีน เลิกฉีดซิโนแวค 2 เข็ม
รักษาชีวิตให้ทัน
เมื่อตรวจเชื้อได้เร็วขึ้นในสถานการณ์ที่เตียงโรงพยาบาลและโรงพยาบาลสนามเริ่มล้น กระทรวงสาธารณสุขและหน่วยต่าง ๆ พยายามเอาผู้ป่วย “กลุ่มสีเขียว” ออกจากสถานพยาบาล รักษาชีวิตผู้ป่วย “กลุ่มสีแดง” และ “สีเหลือง” ที่มีอาการหนักไว้ก่อน
แต่หากเป็นผู้ติดเชื้อที่ตรวจหาเชื้อด้วยตัวเอง หรือแม้แต่ใช้บริการแล็บเอกชน แต่ยังไม่แสดงอาการ หรือเป็นผู้ป่วยกลุ่มสีเขียว คำถามที่เกิดขึ้นคือ จะต้องทำอย่างไรต่อ?
สำนักงานหลักประกันสุขภาพแห่งชาติ (สปสช.) ให้แนวทางไว้ว่า หากพบผลตรวจเป็นบวก (ติดเชื้อ) จะต้องเข้าสู่ระบบ Home หรือ Community isolation เช่น เจ้าหน้าที่ด้านสาธารณสุข จับคู่กับคลินิกใกล้บ้าน เพื่อทำหน้าที่ดูแลผู้ติดเชื้อ หรือให้ติดต่อคลินิกชุมชนอบอุ่น และต้องติดต่อกลับภายใน 48 ชั่วโมง ระบบนี้จะถูกใช้เฉพาะในพื้นที่กรุงเทพมหานคร เพราะในจังหวัดอื่น ๆ มีระบบแพทย์ปฐมภูมิแบบนี้กระจายอยู่ในชุมชนอยู่แล้ว
แต่หากวันนี้เป็นผู้ป่วยสีเขียว และอีก 3-4 วันต่อมาอาการเปลี่ยนทรุด ปอดติดเชื้อ ศูนย์บริการสาธารณสุขของกรุงเทพมหานคร หรือคลินิกอบอุ่นในเครือข่ายการรักษาของ สปสช. ก็ดี จะหาเตียงให้ผู้ป่วยได้อย่างไร?
เร่งสร้างภูมิคุ้มกัน
นอกจากภูมิคุ้มกันตามธรรมชาติ จากการติดเชื้อและรักษาหายแล้ว “วัคซีน” คือภูมิคุ้มกันที่มนุษย์สร้างขึ้น เพื่อปกป้องอันตรายจากไวรัสที่กลายพันธุ์ไม่หยุดนิ่ง แต่ในประเทศไทย ประชากรกลุ่มใหญ่ที่เข้ารับวัคซีน โดยเฉพาะก่อนเดือนมิถุนายน รับวัคซีนซิโนแวค (Sinovac) ชนิดเชื้อตาย ที่ผลการวิจัยหลายแหล่งยืนยันตรงกันว่า เอาไม่อยู่ ในกลุ่มไวรัสกลายพันธุ์ เช่น เดลตา เบตา หรือแลมบ์ดา
นั่นทำให้ที่ประชุมของคณะกรรมการโรคติดต่อแห่งชาติ มีมติเห็นชอบการให้วัคซีนโควิด-19 สลับชนิดกัน เมื่อวันที่ 12 ก.ค. 2564 โดยเฉพาะอย่างยิ่ง กรณีที่มีการฉีดวัคซีน เข็มที่ 1 เป็นซิโนแวค ให้ตามด้วยวัคซีนแอสตราเซเนกา เป็นเข็มที่ 2 ระยะห่าง 3-4 สัปดาห์
ศ. นพ.ยง ภู่วรวรรณ หัวหน้าศูนย์เชี่ยวชาญเฉพาะทางด้านไวรัสวิทยาคลินิก ภาควิชากุมารเวชศาสตร์ คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย อธิบายเรื่องนี้ว่า มาจากสาเหตุ “ปริมาณวัคซีนในไทยมีจำกัด” ทำให้ประชาชนที่ได้รับวัคซีนแล้ว มีน้อยกว่าเป้าหมายที่วางไว้ กล่าวคือนับตั้งแต่ไทยเริ่มฉีดวัคซีนเมื่อวันที่ 28 ก.ค. ซึ่งจนถึงขณะนี้ ยังฉีดได้ไม่ถึง 13 ล้านโดส
“อีกสาเหตุหนึ่งก็คือ วัคซีนต้านโควิดระยะแรกผลิตโดยใช้สายพันธุ์ที่มีต้นกำเนิดในเมืองอู่ฮั่น ประเทศจีน แต่ขณะนี้ไวรัสมีการกลายพันธุ์ ทำให้ประสิทธิภาพของวัคซีนที่ผลิตรุ่นแรกประสิทธิภาพดลง เมื่อต้องใช้รับมือกับสายพันธุ์ที่ระบาดอยู่ในปัจจุบัน”
และคณะกรรมการโรคติดต่อแห่งชาติ ยังมีมติถึงบุคลากรทางการแพทย์ที่ส่วนใหญ่ฉีดวัคซีนซิโนแวคครบสองเข็มแล้วให้ฉีดแอสตราเซเนกาเป็นเข็มที่สาม หรือแม้แต่วัคซีนชนิด mRNA ที่หลายฝ่ายกำลังเรียกร้อง หลังจากนั้นจึงฉีดเข็มสามกระตุ้มให้กับกลุ่มเป้าหมายอื่นที่ฉีดวัคซีนซิโนแวคไปแล้วเช่นกัน
แต่โจทย์ที่ยากไปกว่ายุทธศาสตร์วัคซีนที่ต้องปรับให้ทันกับสถานการณ์ตลอดเวลา คือ เรามีวัคซีนอยู่ในมือพร้อมใช้มากแค่ไหน?
“เดลตา” ไม่ใช่สายพันธุ์เดียว ที่น่ากังวล!
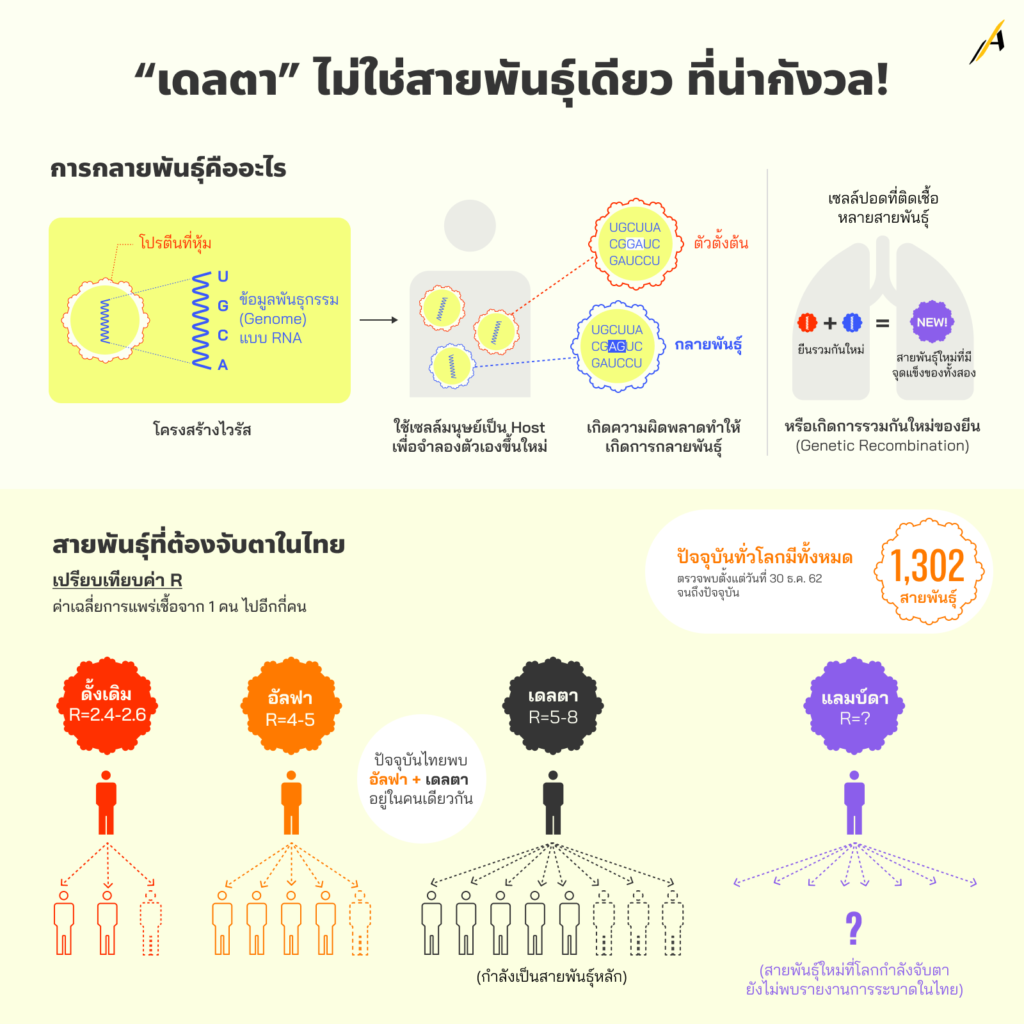
โคโรนาไวรัส เป็นไวรัสในอาณาจักร Orthornavirae ซึ่งเป็นอาณาจักรของไวรัสที่มีลักษณะ 2 ประการ คือ 1) มีข้อมูลพันธุกรรมทั้งหมด หรือที่เรียกว่า จีโนม (Genome) ประกอบขึ้นจากกรดไรโบนิวคลีอิก (Ribonucleic acid, RNA) โดยเราสามารถเรียกไวรัสที่มีลักษณะนี้ ทั้งที่อยู่ในและนอกอาณาจักร Orthornavirae รวมกันว่า ไวรัสแบบ RNA และ และ 2) มีการใส่รหัสทางพันธุกรรมโดยใช้เอนไซม์โพลีเมอเรสแบบกรดไรโบนิวคลีอิกที่ขึ้นกับกรดไรโบนิวคลีอิก (RNA-dependent RNA polymerase, RdRp)
เมื่อเจาะผนังเซลล์เจ้าบ้าน (คนหรือสัตว์) สำเร็จ โคโรนาไวรัสจะใช้ RdRp นี้ทำสำเนาจีโนมของตัวเองออกมาในรูปของ messenger RNA (mRNA) เพื่อสั่งให้กลไกภายในเซลล์เจ้าบ้าน สร้างส่วนประกอบต่าง ๆ ของไวรัส แล้วประกอบกันขึ้นเป็นไวรัสตัวใหม่ เรียกว่า การจำลองตัวเองขึ้นใหม่ (Replication) ซึ่งเป็นการติดเชื้อในระดับเซลล์และเป็นการขยายพันธุ์ของไวรัส โดยเซลล์ปอดของมนุษย์ที่ติดเชื้อ 1 เซลล์ สามารถผลิตไวรัสลูกให้โคโรนาไวรัสได้ประมาณ 1 แสนตัว (100,000 Virions)
ไวรัสในอาณาจักร Orthornavirae มีอัตราของการกลายพันธุ์ (Mutation) การรวมกันใหม่ของยีน (Genetic Recombination) และการเข้าชุดยีนใหม่ (Reassortment) ที่สูง
สรุปได้ว่า การกลายพันธุ์ เกิดขึ้นเมื่อมีความผิดพลาดในกระบวนการทำสำเนาจีโนม จะทำให้ไวรัสลูกที่ผลิตขึ้นใหม่ภายในเซลล์เจ้าบ้าน มีพันธุกรรมที่แตกต่างจากไวรัสที่ทำให้เซลล์นั้นติดเชื้อ โดยการกลายพันธุ์ส่วนใหญ่จะสร้างไวรัสลูกที่อ่อนแอลง แต่บางการกลายพันธุ์ จะสร้างไวรัสลูกที่มีความได้เปรียบมากขึ้นในสิ่งแวดล้อมเดิม ทำให้ไวรัสลูกที่มีพันธุกรรมใหม่นี้เพิ่มจำนวนขึ้นอย่างรวดเร็วได้
ตัวเลขที่ยืนยันข้อเท็จจริงนี้ คือ การเปิดเผยโดย cov-lineages.org ที่รวบรวมและบันทึกสายพันธุ์ของโคโรนาไวรัสที่ทำให้เกิดการระบาดโควิด-19 เท่าที่มีการตรวจพบทั่วโลก ตั้งแต่วันที่ 30 ธ.ค. 2562 ถึง 12 ก.ค. 2564 ได้ 1,302 สายพันธุ์
อย่างไรก็ตาม WHO จำแนกเชื้อกลายพันธุ์ไว้เป็น 2 กลุ่ม คือ เชื้อกลายพันธุ์ที่น่ากังวล (Variants of Concern หรือ VOC) และเชื้อกลายพันธุ์ที่น่าสนใจ (Variants of Interest หรือ VOI) ดังนี้
เชื้อกลายพันธุ์ที่น่ากังวล ซึ่งมีการกลายพันธุ์ในระดับที่มีนัยสำคัญต่อสาธารณสุขโลก เช่น แพร่ระบาดได้ง่ายขึ้น หรือทำให้วัคซีนมีประสิทธิภาพลดลง มีชื่อตามอักษรกรีก
- อัลฟา (Alpha) ใช้เรียกสายพันธุ์ B.1.1.7 ที่ตรวจพบครั้งแรกในสหราชอาณาจักร
- เบตา (Beta) ใช้เรียกสายพันธุ์ B.1.351 ที่ตรวจพบครั้งแรกในแอฟริกาใต้
- แกมมา (Gamma) ใช้เรียกสายพันธุ์ P.1 ที่ตรวจพบครั้งแรกในบราซิล
- เดลตา (Delta) ใช้เรียกสายพันธุ์ B.1.617.2 ที่ตรวจพบครั้งแรกในอินเดีย
เชื้อกลายพันธุ์ที่น่าสนใจ หรือน่าจับตา มีชื่อตามอักษรกรีก
- เอปไซลอน (Epsilon) ใช้เรียกสายพันธุ์ B.1.427/B.1.429 ที่ตรวจพบครั้งแรกในสหรัฐฯ
- ซีตา (Zeta) ใช้เรียกสายพันธุ์ P.2 ที่ตรวจพบครั้งแรกในบราซิล
- อีตา (Eta) ใช้เรียกสายพันธุ์ B.1.525 ที่ตรวจพบครั้งแรกในหลายประเทศ
- ธีตา (Theta) ใช้เรียกสายพันธุ์ P.3 ที่ตรวจพบครั้งแรกในฟิลิปปินส์
- ไอโอตา (Iota) ใช้เรียกสายพันธุ์ B.1.526 ที่ตรวจพบครั้งแรกในสหรัฐฯ
- แคปปา (Kappa) ใช้เรียกสายพันธุ์ B.1.617.1 ที่ตรวจพบครั้งแรกในอินเดีย
ทั้งนี้ ข้อมูลการเฝ้าระวังทั้งประเทศจากกรมวิทยาศาสตร์การแพทย์ ของไทย ตั้งแต่วันที่ 1 เม.ย. – 9 ก.ค. 2564 สายพันธุ์อัลฟา จำนวน 11,267 คน (74.08%) สายพันธุ์เดลตา จำนวน 3,672 คน (24.14%) และสายพันธุ์เบตา จำนวน 271 คน (1.78%) สัดส่วนสายพันธุ์ที่เฝ้าระวังสะสมทั้งประเทศ พบสายพันธุ์อัลฟามากที่สุด แต่มีแนวโน้มลดลง ส่วนสายพันธุ์เดลตา มีแนวโน้มเพิ่มขึ้นทุกสัปดาห์
และ นพ.ศุภกิจ ศิริลักษณ์ อธิบดีกรมวิทยาศาสตร์การแพทย์ เปิดเผยว่า ยังพบตัวอย่างที่มีการติดเชื้อร่วมของทั้ง 2 สายพันธุ์ (Mix infection) สายพันธุ์อัลฟาและสายพันธุ์เดลตาร่วมกันเป็นแบบลักษณะร่วม (Heterozygous) อีก 7 ตัวอย่างจากคนงานในแคมป์ก่อสร้าง ซึ่งทั้งหมดพบว่า ไม่มีรายใดได้รับวัคซีน และทุกรายไม่มีอาการรุนแรงหรือเสียชีวิต
อย่างไรก็ตามการติดเชื้อร่วม 2 สายพันธุ์ในผู้ป่วยคนเดียวเป็นที่น่ากังวลใจอย่างยิ่ง เนื่องจากอาจนำไปสู่การเกิดไวรัสลูกผสมได้ รวมทั้งอาจส่งผลต่อประสิทธิผลของวัคซีน
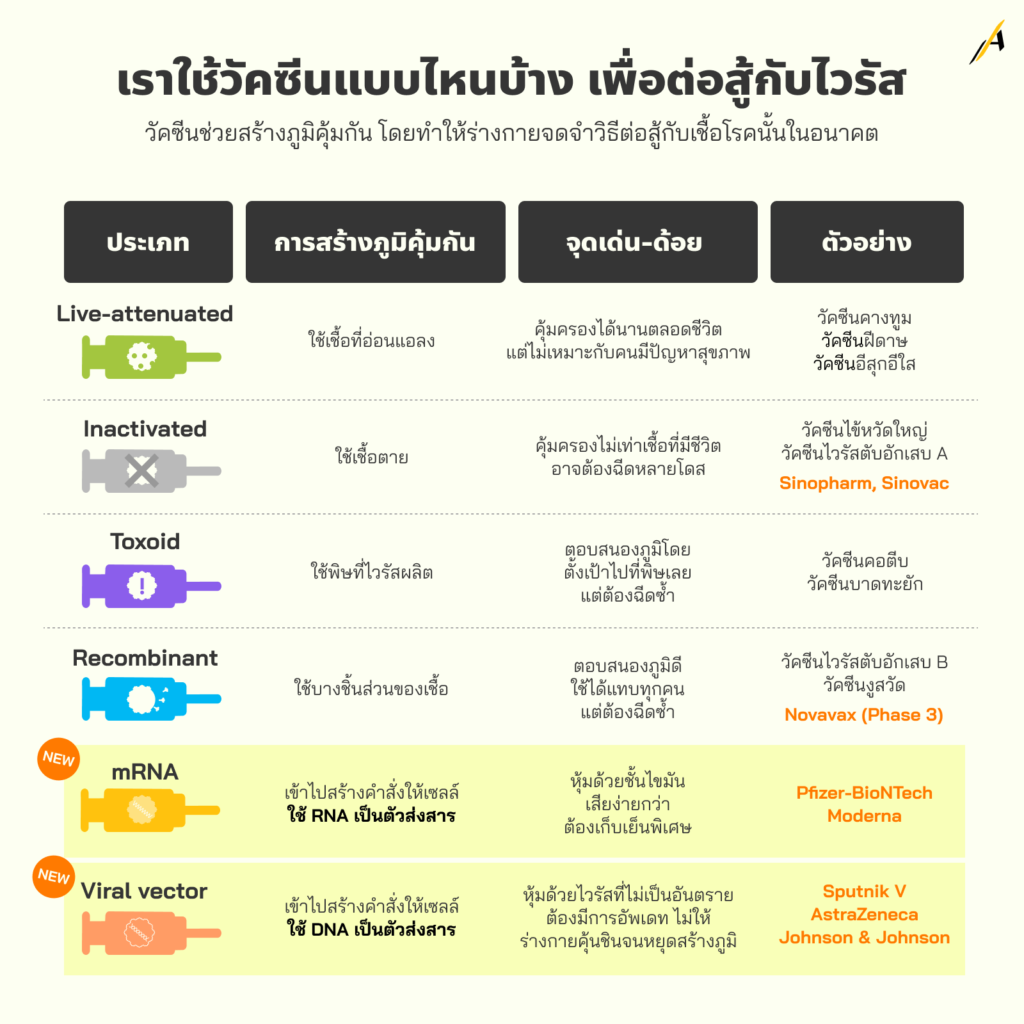
เราใช้วัคซีนแบบไหนบ้าง เพื่อต่อสู้กับไวรัส
“วัคซีน” เป็นตัวช่วยให้ร่างกายพัฒนาภูมิคุ้มกันต่อโรคนั้น โดยไม่ทำให้ร่างกายป่วย
การทำงานของวัคซีนแต่ละชนิดอาจแตกต่างกัน แต่มีหลักการร่วมกัน คือ จะทำให้ร่างกายหลงเหลือปริมาณเซลล์ความทรงจำ ที่จะจดจำวิธีต่อสู้กับเชื้อโรคนั้นในอนาคต
ในสงครามไวรัสเกือบสองปีที่ผ่านมา โลกได้พัฒนาวัคซีนใหม่สองชนิด คือ mRNA และ Viral vector แต่จริง ๆ แล้ว โลกมีประเภทวัคซีนหลายชนิดที่เคยรับมือกับโรคระบาดในอดีตมาแล้ว
และการจะรับมือกับโรคระบาดในปัจจุบัน เราใช้วัคซีนแบบไหนบ้าง เพื่อต่อสู้กับไวรัสกลายพันธุ์?
1) วัคซีนที่ใช้เชื้อเป็นแต่อ่อนแอ (Live-attenuated vaccines) มีกระบวนการทำงาน ที่สร้างภูมิกันโดยใช้เชื้อโรคที่ถูกทำให้อ่อนแอลงหรือมีปริมาณน้อย จุดแข็ง ทำให้เกิดการตอบสนองทางภูมิคุ้มกันที่แข็งแกร่งและอยู่ยาวนาน การฉีดเพียง 1-2 โดส สามารถให้ความคุ้มครองจากเชื้อโรคและโรคนั้นคลอดชีวิต ขณะที่ จุดอ่อน คือ บุคคลบางกลุ่ม เช่น ผู้ที่มีปัญหาภูมิคุ้มกันอ่อนแอ หรือมีปัญหาสุขภาพระยะยาว หรือผู้ได้รับการปลูกถ่ายอวัยวะ ฯลฯ ต้องได้รับคำปรึกษาจากผู้เชี่ยวชาญก่อน
ตัวอย่างโรคที่ป้องกันด้วยวัคซีนชนิดนี้ ได้แก่ โรคหัด (Measles) โรคคางทูม (Mumps) โรคหัดเยอรมัน (Rubella) ซึ่งใช้วัคซีนร่วมกันเรียกว่า MMR combined กับโรคที่เกิดจากไวรัสโรตา (Rotavirus) โรคไข้ทรพิษหรือฝีดาษ (Smallpox) โรคอีสุกอีใส (Chickenpox หรือ Varicella) ไข้เหลือง (Yellow Fever)
2) วัคซีนที่ใช้เชื้อตาย (Inactivated vaccines) มีกระบวนการทำงาน ที่จะสร้างภูมิกันโดยใช้เชื้อโรคที่ตายแล้ว จุดอ่อน ไม่ได้ให้ภูมิคุ้มกัน (ความคุ้มครอง) ที่แข็งแกร่งเท่า Live-attenuated vaccines จึงอาจต้องฉีดหลายโดสจนกว่าจะได้รับภูมิคุ้มกัน ซึ่งตัวอย่างวัคซีนโควิด-19 ชนิดนี้ คือ BBIBP-CorV ของซิโนฟาร์ม, CoronaVac (Sinovac) ของซิโนแวค ไบโอเทค, Covaxin ของภารัตไบโอเทค ร่วมมือกับ Indian Council of Medical Research, WIBP-CorV ของซิโนฟาร์ม, และ CoviVac ของชูมาคอฟ ใน Russian Acdemy of Sciences
ตัวอย่างโรคที่ป้องกันด้วยวัคซีนชนิดนี้ ได้แก่ โรคตับอักเสบ A (Hepatitis A) ไข้หวัดใหญ่ (Flu หรือ Influenza) โรคโปลิโอ (Polio) โรคพิษสุนัขบ้า (Rabies)”
3) วัคซีนที่ใช้พิษไวรัสผลิต (Toxoid vaccines) กระบวนการทำงาน คือ สร้างภูมิกันโดยใช้สารพิษที่ไวรัสนั้นผลิต ทำให้การตอบสนองของภูมิคุ้มกันถูกตั้งเป้าไปที่สารพิษนั้น แทนที่จะเป็นเชื้อโรค จุดอ่อน อาจต้องใช้การฉีดซ้ำเพื่อคงความคุ้มครองต่อโรคนั้นไว้
ตัวอย่างโรคที่ป้องกันด้วยวัคซีนชนิดนี้ ได้แก่ โรคคอตีบ (Diphtheria) โรคบาดทะยัก (Tetanus หรือ Lockjaw)
4) วัคซีนที่ใช้บางชิ้นส่วนของเชื้อ (Subunit, recombinant, polysaccharide, และ conjugate vaccines) มีกระบวนการทำงาน โดยจะสร้างภูมิกันโดยใช้ชิ้นส่วนของเชื้อโรคนั้น เช่น โปรตีน น้ำตาล หรือเปลือกหุ้มสารพันธุกรรมของไวรัส (Capsid) จุดแข็ง สามารถกระตุ้นการตอบสนองทางภูมิคุ้มกันที่แข็งแกร่งมากต่อส่วนประกอบของไวรัสที่เป็นเป้าหมาย และสามารถใช้สำหรับทุกคนที่ต้องการการคุ้มครอง รวมถึงผู้ที่มีปัญหาสุขภาพระยะยาว จุดอ่อน อาจต้องใช้การฉีดซ้ำเพื่อคงความคุ้มครองต่อโรคนั้นไว้
สำหรับโคโรนาไวรัส มีตัวอย่างวัคซีนที่อยู่ระหว่างการทดลองใช้ คือ NovaVax (รัฐบาลสหรัฐฯ ยังให้อยู่ใน Large-Scale (Phase 3) Clinical Trials
ตัวอย่างโรคที่ป้องกันด้วยวัคซีนชนิดนี้ ได้แก่ โรคฮิบ (Haemophilus Influenzae Type B, HiB) โรคตับอักเสบ B (Hepatitis B) โรค HPV โรคไอกรน (Whooping Cough หรือ Pertussis) โรคนิวโมคอคคัส (Pneumococcal disease) โรคไข้กาฬหลังแอ่น (Meningococcal disease) โรคงูสวัด (Shingles หรือ Herpes Zoster)
5) วัคซีนที่เข้าไปสร้างคำสั่งให้เซลล์ใช้ RNA เป็นตัวส่งสาร (Messenger RNA) vaccines ได้แก่ วัคซีน Comirnaty ของบริษัท Pfizer-BioNTech (สัญชาติเยอรมัน) (รัฐบาลสหรัฐฯ อนุมัติแล้ว), วัคซีนของบริษัท Moderna โดยความร่วมมือกับ United States National Institute of Allergy and Infectious Diseases (NIAID) และ Biomedical Advanced Research and Development Authority (BARDA) (รัฐบาลสหรัฐฯ อนุมัติแล้ว)
กระบวนการทำงานของวัคซีน
- วัคซีนชนิดนี้ เมื่อเข้าไปภายในผนังเซลล์ภูมิคุ้มกัน จะให้ “คำสั่ง” (Instruction) ต่อเซลล์ภูมิคุ้มกัน ให้ผลิตชิ้นส่วน “โปรตีนหนาม” (Spike Protein) ของไวรัสโควิด-19 ขึ้น เมื่อเซลล์นั้นผลิตโปรตีนหนามแล้ว จะทำลายคำสั่งนี้
- โปรตีนหนามนี้จะปรากฏบนผิวของเซลล์นั้น ระบบภูมิคุ้มกันของร่างกายจะทราบว่า โปรตีนชนิดนี้แปลกปลอม จึงสร้างปฏิกิริยาภูมิคุ้มกันตอบสนองและสร้าง Antibodies เข้าจัดการ เช่นเดียวกับที่เกิดขึ้นกับการติดเชื้อโควิด-19 จริง ๆ
- เมื่อสิ้นสุดกระบวนการ ร่างกายจะเรียนรู้วิธีการปกป้องตัวเองจากการติดเชื้อในอนาคต ข้อดี เป็นเหมือนเช่นวัคซีนทุกตัว คือ ผู้ที่ฉีดวัคซีนจะได้รับความคุ้มครองโดยไม่ต้องเสี่ยงกับผลกระทบต่าง ๆ ที่เกิดจากการติดเชื้อจริง
6) วัคซีนเข้าไปสร้างคำสั่งให้เซลล์ใช้ DNA เป็นตัวส่งสาร (Viral Vector vaccines) ได้แก่ Sputnik Light, Sputnik V, Oxford-AstraZeneca (รัฐบาลสหรัฐฯ ยังให้อยู่ใน Large-Scale (Phase 3) Clinical Trials), Convidecia ของ CanSino Biologics, และวัคซีนของบริษัท Janssen ของ Johnson & Johnson (รัฐบาลสหรัฐฯ อนุมัติแล้ว)
กระบวนการทำงานของวัคซีน
- วัคซีนชนิดนี้ จะเป็นไวรัสที่ไม่ก่อให้เกิดโรค ที่เมื่อเข้าไปภายในผนังเซลล์ จะใช้กลไกของเซลล์นั้นผลิตชิ้นส่วนโปรตีนหนามของไวรัสโควิด-19 ขึ้น
- โปรตีนหนามนี้จะปรากฏบนผิวของเซลล์นั้น ระบบภูมิคุ้มกันของร่างกายจะทราบว่า โปรตีนชนิดนี้แปลกปลอม จึงสร้างปฏิกิริยาภูมิค้มกันตอบสนองและสร้าง Antibodies เข้าจัดการสิ่งที่ร่างกายเข้าใจว่าคือการติดเชื้อ
- เมื่อสิ้นสุดกระบวนการ ร่างกายจะเรียนรู้วิธีการปกป้องตัวเองจากการติดเชื้อในอนาคต ข้อดีเป็นเหมือนเช่นวัคซีนทุกตัว คือ ผู้ที่ฉีดวัคซีนจะได้รับความคุ้มครองโดยไม่ต้องเสี่ยงกับผลกระทบต่าง ๆ ที่เกิดจากการติดเชื้อจริง
ประเทศที่มียอดผู้เสียชีวิตสะสมสูง แต่ปัจจุบันมีอัตราการเสียชีวิตลดลง
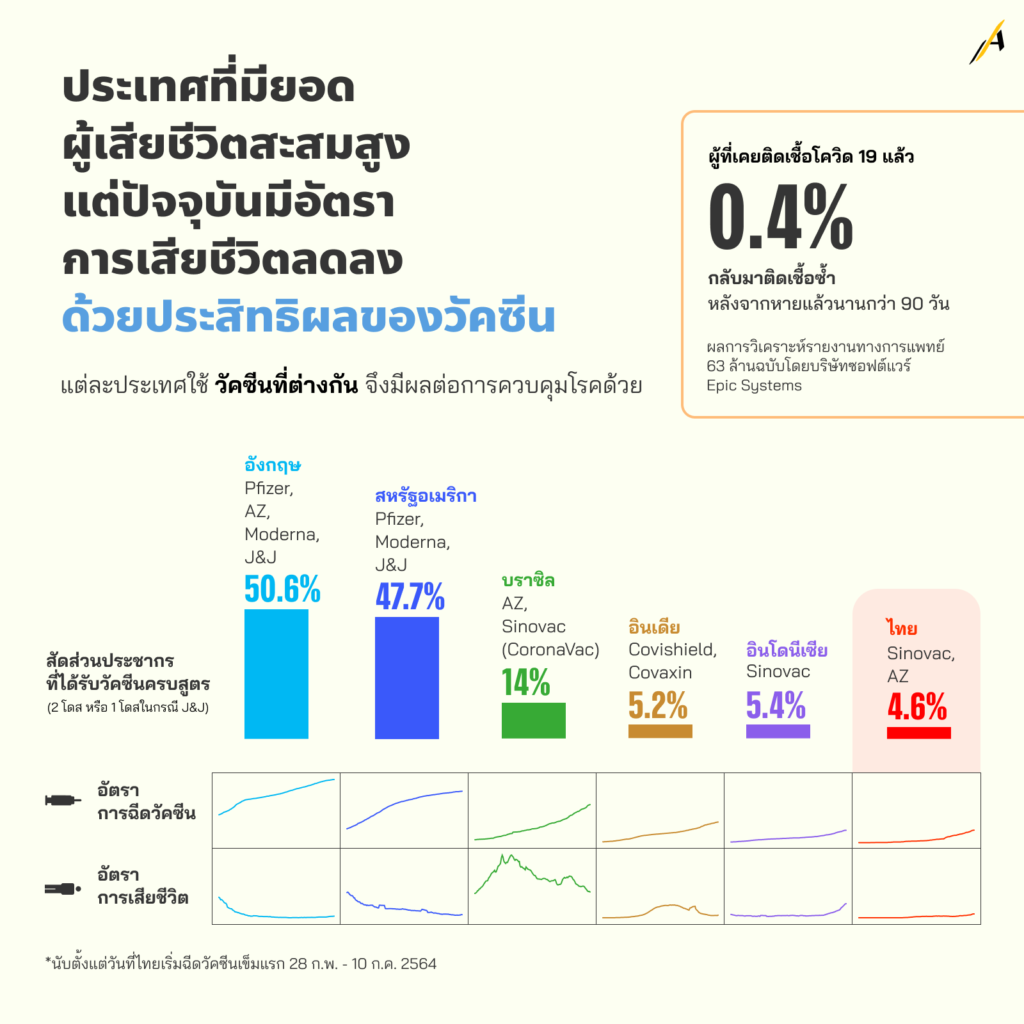
เมื่อศึกษาข้อมูลในประเทศที่ได้รับการฉีดวัคซีนโควิด-19 ในประชากรจำนวนมาก จะเห็นได้ว่ายังพบผู้ติดเชื้อรายใหม่ทุกวัน แต่สิ่งที่แตกต่าง คือ จำนวนผู้เสียชีวิต ที่ลดลงอย่างเห็นได้ชัด
ตัวอย่างชัดเจนเกิดขึ้นที่ประเทศอังกฤษ จากประเทศที่มีผู้ติดเชื้อสะสมกว่า 5 ล้านคน และผู้เสียชีวิตสะสมกว่า 1.2 แสนคน ข้อมูลล่าสุด ณ วันที่ 14 ก.ค. 2564 แม้มีผู้ติดเชื้อรายใหม่ 36,216 คน แต่ยอดผู้เสียชีวิตมีเพียง 50 คนเท่านั้น ซึ่งนี่เป็นตัวเลขผู้ติดเชื้อที่เพิ่งจะสูงขึ้นช่วงการแข่งขันฟุตบอลชิงแชมป์แห่งชาติยุโรป (EURO 2020) เมื่อเดือนมิถุนายนต่อเนื่องกรกฎาคมที่ผ่านมา ที่อังกฤษเป็นเจ้าภาพร่วม และเมื่อเปรียบเทียบกัน จะเห็นว่าสถานการณ์เช่นนี้เกิดขึ้นคล้ายกันในหลายประเทศ
หรือการศึกษาหนึ่งของบริษัทซอฟต์แวร์ด้านการดูแลสุขภาพ Epic Systems ได้ทำการวิเคราะห์บันทึกทางการแพทย์ 63 ล้านรายการ พบว่า จากประชาชนจำนวนประมาณ 4 แสนคน ที่เคยมีผลตรวจโคโรนาไวรัสเป็นบวก มีเพียง 0.4% ที่มีผลบวกซ้ำ 2 ครั้งในช่วงเวลาห่างกันมากกว่า 90 วัน
อีกการศึกษาหนึ่งทำกับบุคลากรด้านการดูแลสุขภาพ (Health Care Worker) 20,000 คนในสหราชอาณาจักรพบว่า ความเสี่ยงในการติดเชื้ออีกครั้ง (Reinfection) ลดลง 83% ในช่วงเวลาอย่างน้อย 5 เดือน หลังจากการติดเชื้อครั้งแรก
และอีกการศึกษาหนึ่งที่ทำการคัดกรอง (Screening) ประชาชน 43,000 คน ในประเทศกาตาร์ (Qatar) ด้วยวิธีตรวจสอบแบบ PCR พบว่า หลังจากการติดเชื้อครั้งแรกอย่างน้อย 7 เดือน ร่างกายจะได้รับความคุ้มครองจากการติดเชื้อซ้ำ 95%
ผลข้างเคียง vs ประสิทธิผล: วัคซีนกับประสิทธิผลต่อสายพันธุ์ไวรัสที่ต่างกัน
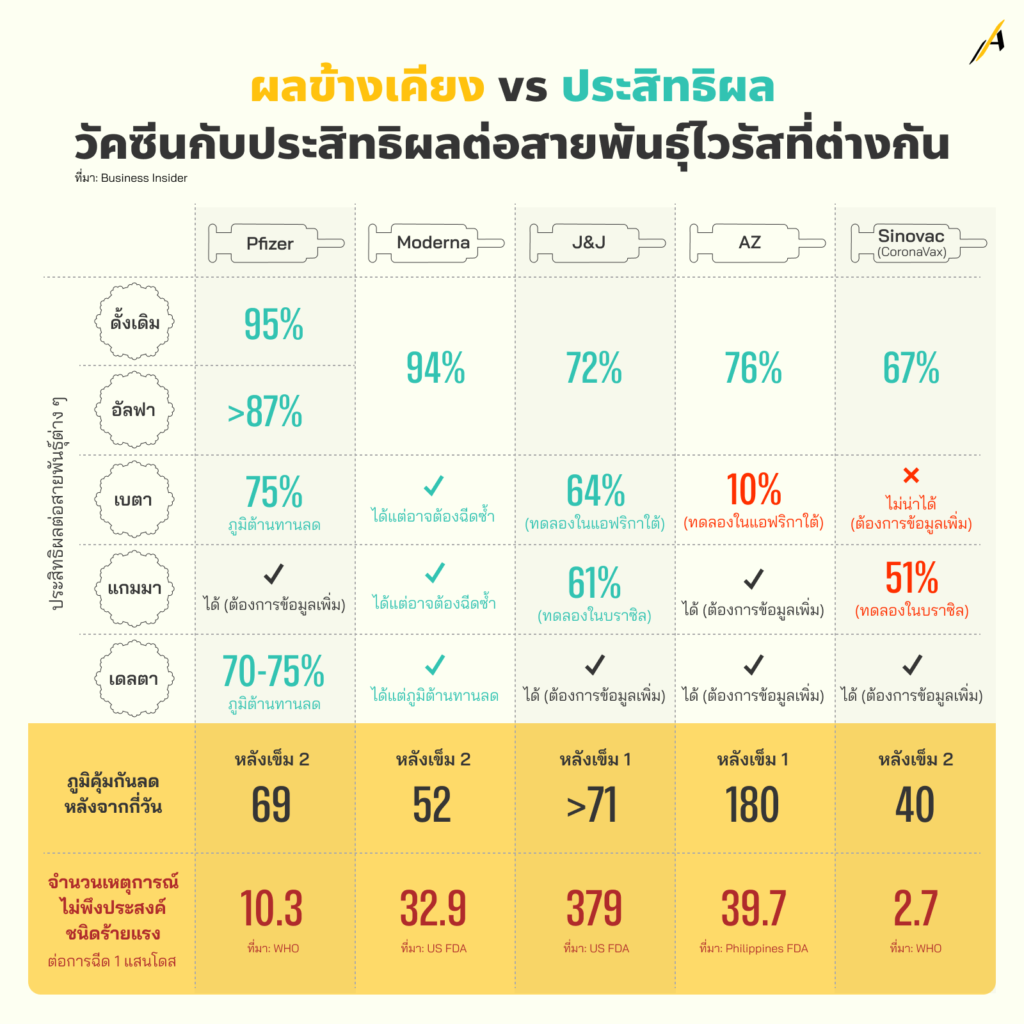
สำนักข่าว Bloomberg รายงานว่า นักวิทยาศาสตร์มุ่งความสนใจส่วนใหญ่ไปที่การกลายพันธุ์ของยีนที่เข้ารหัสโปรตีนหนามแหลม (Spike Protein) ของไวรัส ซึ่งมีบทบาทสำคัญในการที่ไวรัสจะเจาะเข้าสู่เซลล์และเป็นเป้าหมายของวัคซีนต่าง ๆ
ส่วนสายพันธุ์ที่ควรกังวล ทั้ง 4 สายพันธุ์ คือ อัลฟา เบตา แกมมา และเดลตา ล้วนมีการกลายพันธุ์หลายครั้งที่โปรตีนหนามแหลม
เดือนพฤษภาคม 2564 นักวิจัยจาก University of Florida ตีพิมพ์ผลการวิจัยที่ยังไม่ถูก Peer review หรือยังไม่ได้รับรองโดยคณะผู้เชี่ยวชาญสำหรับแต่ละสาขา ซึ่งค้นพบว่า สำหรับวัคซีนต่าง ๆ ที่กำลังถูกผลิตออกสู่ทั้งโลกในขณะนี้ สายพันธุ์อัลฟาทำให้ประสิทธิผลของวัคซีนลดลงบ้าง (somewhat reduced) เมื่อเทียบกับสายพันธุ์ทั่วไป ส่วนสายพันธุ์เบตาและแกมมา ทำให้ประสิทธิผลของวัคซีนลดลงอย่างมาก
สำหรับสายพันธุ์เดลตา นั้น Public Health England บ่งชี้ว่า วัคซีนต่าง ๆ 2 โดส มีประสิทธิผลในการป้องกันการป่วยแบบมีอาการเพียง 79% (เปรียบเทียบกับอัลฟา ที่ 89%) ในขณะที่เมื่อฉีดวัคซีนเหล่านั้นเพียงเข็มเดียว จะมีประสิทธิผลเหลือเพียง 35% (เปรียบเทียบกับอัลฟา ที่ 49%)
นอกจากนี้ ยังมีงานวิจัยอื่นบ่งชี้ว่า แม้ปริมาณแอนติบอดีจะลดลง ระบบภูมิคุ้มกันส่วนอื่น ๆ อาจจะสามารถต่อสู้กับโคโรนาไวรัสได้
สำหรับ เหตุการณ์ไม่พึงประสงค์ ของวัคซีนแต่ละชนิด จากการทดลองหลังการใช้ วัคซีนชนิด mRNA ของไฟเซอร์ ในประเทศชิลี พบเหตุการณ์ไม่พึงประสงค์ชนิดร้ายแรง 10.26 เหตุการณ์ต่อ 1 แสนโดส มีอาการกล้ามเนื้อหัวใจอักเสบ (Myocarditis) หรือ เยื่อหุ้มหัวใจอักเสบ (Pericarditis) เกิดขึ้น 13 ครั้งต่อประชากร 1 ล้านคน ที่มีอายุน้อยและฉีดวัคซีนไฟเซอร์หรือโมเดอร์นา โดยส่วนใหญ่เป็นชายอายุ 16 ปีขึ้นไป (Centers for Disease Control and Prevention สหรัฐฯ)
ขณะที่วัคซีน โมเดอร์นา ในผลการทดลอง Phase II กับกลุ่มทดลอง 600 คน พบว่าเกิด ‘Serious Adverse Event’ (SAE) เหตุการณ์ไม่พึงประสงค์ชนิดร้ายแรง 3 เหตุการณ์ต่อ 600 ราย หรือ 500 เหตุการณ์ต่อ 1 แสนราย ส่วนผลการทดลอง Phase III กับกลุ่มทดลองประมาณ 30,400 คน พบ SAEs 82 เหตุการณ์ในกลุ่มที่ฉีดวัคซีน 15,184 ราย (คิดเป็น 540 เหตุการณ์ใน 1 แสนโดส) และ 86 เหตุการณ์ในกลุ่มที่ฉีดยาหลอก (Placebo) 15,165 ราย (567 เหตุการณ์ใน 1 แสนโดส)
ทั้งนี้ ผู้ตรวจสอบ (Investigator) ระบุว่า มี SAEs ที่เกี่ยวข้อง (Related) กับการทดลองนี้ 5 เหตุการณ์ในกลุ่มที่ฉีดวัคซีน (32.93 เหตุการณ์ใน 1 แสนโดส) และ 5 เหตุการณ์ในกลุ่มที่ฉีดยาหลอก (32.97 เหตุการณ์ใน 1 แสนโดส)
วัคซีนจาก จอห์นสัน แอนด์ จอห์นสัน ในการทดลอง COV3001 ที่สิ้นสุดในวันที่ 22 ม.ค. 2564 ผู้ร่วมการทดลอง 54.6% ได้รับการติดตาม 8 สัปดาห์ โดยมีมัธยฐานอยู่ที่ 58 วัน จำนวน SAEs ที่ไม่ร่วมอาการจากการติดเชื้อโควิด-19 ที่ได้รับการยืนยันแล้ว คือ 83 เหตุการณ์ จากผู้ได้รับวัคซีน J&J 21,895 ราย (คิดเป็น 379.08 เหตุการณ์ต่อ 1 แสนโดส) และ 96 เหตุการณ์จากผู้ได้รับยาหลอก 21,888 ราย (คิดเป็น 438.60 เหตุการณ์ต่อ 1 แสนโดส)
SAEs เฉพาะที่เป็น “การเกิดลิ่มเลือดพร้อมเกร็ดเลือกต่ำ” (blood clots with low platelets) หรือ Thrombosis with Thrombocytopenia Syndrome (TTS) มีจำนวน 7 ครั้งต่อผู้ฉีดวัคซีน 1 ล้านคนที่เป็นหญิงและมีอายุระหว่าง 18 – 49 ปี
วัคซีน แอสตราเซเนกา องค์การอาหารและยา (FDA) ของฟิลิปปินส์ เก็บรวบรวมข้อมูลรายงานเกี่ยวกับปฏิกิริยาตั้งแต่เริ่มต้นโครงการฉีดวัคซีนในวันที่ 1 มี.ค. – 11 เม.ย. 2564 และพบว่า จากจำนวนผู้ได้รับวัคซีนแอสตราฯ 1 โดส 511,199 คน (ยังไม่มีผู้ได้รับวัคซีนแอสตราฯ โดสที่ 2 ในขณะนั้น) มี SAE 203 เหตุการณ์ (คิดเป็น 39.71 เหตุการณ์ต่อ 1 แสนโดส)
ส่วนวัคซีน ซิโนแวค นั้น พบเหตุการณ์ไม่พึงประสงค์ชนิดร้ายแรง 2.67 เหตุการณ์ต่อ 1 แสนโดส ในประเทศชิลี
ขณะที่ องค์การอาหารและยา (FDA) ของฟิลิปปินส์ เก็บรวบรวมข้อมูลรายงานเกี่ยวกับปฏิกิริยาตั้งแต่เริ่มต้นโครงการฉีดวัคซีนในวันที่ 1 มี.ค. – 11 เม.ย. 2564 และพบว่า จากจำนวนผู้ได้รับวัคซีนโคโรนาแวค หรือซิโนแวค 1 โดส 515,359 ราย และ 2 โดส 140,043 ราย มี SAE 161 เหตุการณ์ (คิดเป็น 20.24 ครั้งต่อ 1 แสนโดส)
บทส่งท้าย
ประเทศไทย นอกจากขาดอาวุธหนักและยุทธศาสตร์การรบที่ดี ยังเป็นประเทศที่มีข่าวร้ายรายวัน และมีความพยายามทำให้ประชาชนเชื่อว่า เรามีวัคซีนแอสตราเซเนกาเป็นวัคซีนหลัก เพราะฐานการผลิตอยู่ในประเทศ แต่เมื่อการระบาดระลอกสามมาถึง แรงกดดันทางการเมืองทำให้ต้องไปคว้าวัคซีนเชื้อตาย ซึ่งไม่สามารถสู้กับไวรัสกลายพันธุ์ได้มาเป็นวัคซีนหลักแทน
และล่าสุด วันที่ 15 ก.ค. 2564 สาธิต ปิตุเตชะ รมช.กระทรวงสาธารณสุข ออกมายอมรับผ่านรายการ เจาะลึกทั่วไทย Inside Thailand ว่า “มีข้อคลาดเคลื่อนเรื่องของตัวเลขวัคซีนแอสตราเซเนกา” จากเดิม บริษัท แอสตร้าเซนเนก้า กำหนดส่งมอบวัคซีนให้ไทยจำนวน 61 ล้านโดส ภายในเดือนธันวาคม 2564 แต่มีการขอขยายเวลาออกไป ซึ่งจำวันที่และเดือนไม่ชัดเจน แต่คาดว่าเป็นเดือนพฤษภาคม 2565
ม้าตัวเดียวที่แทงไว้ไม่มาตามนัดแน่ ๆ
ขณะที่ รัฐบาลสั่งวัคซีนซิโนแวคเข้ามาอีกเพิ่ม 10.9 ล้านโดส ภายใต้งบประมาณ 6,100 ล้านบาท ตามมติ ครม. เมื่อ 6 ก.ค. ส่วนวัคซีน mRNA ที่ประชาชนเรียกร้องก็ดูห่างไกลความจริงไปเรื่อย ๆ
จนไม่อยากเชื่อว่าการประกาศล็อกดาวน์ครั้งล่าสุด จะนำมาซึ่งผลลัพธ์ที่ดี…
อ้างอิง
- WHO Coronavirus (COVID-19) Dashboard
- National Center for Biotechnology Information
- From Alpha to Delta, Why Virus Mutations Cause Alarm
- WHO: Tracking SARS-CoV-2 variants
- CDC: Understanding How COVID-19 Vaccines Work
- Vaccine Types
- SARS-CoV-2 evolution and vaccines: cause for concern?
- Why the ongoing mass vaccination experiment drives a rapid evolutionary response of SARS-CoV-2
- Reinfection is possible but rare, data from 63 million medical records shows
- If you’ve had COVID-19 you could be more than 80% protected from reinfection
- COVID-19 reinfection tracker
- ติดแล้วไปไหน? การตรวจหาเชื้อด้วย Antigen Test Kit
- โควิด-19 : องค์การอนามัยโลกตั้งชื่อเรียกใหม่ให้โควิดกลายพันธุ์ตามอักษรกรีก แทนชื่อเรียกตามประเทศ
- แพทย์ชนบท ลุยตรวจโควิด-19 เชิงรุกกรุงเทพฯ
- Serious adverse events reported from the COVID-19 vaccines: A descriptive study based on WHO database
- Reports of Suspected Adverse Reaction to COVID-19 Vaccines
- AstraZeneca vaccine immune response higher with longer gap, third dose
- Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials
- Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial
- WHO Evidence Assessment: Sinovac/CoronaVac COVID-19 vaccine
- EMERGENCY USE AUTHORIZATION (EUA) OF THE JANSSEN COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019 (COVID-19)
- Interim Results of a Phase 1–2a Trial of Ad26.COV2.S Covid-19 Vaccine
- Antibody Persistence through 6 Months after the Second Dose of mRNA-1273 Vaccine for Covid-19
- CDC: Different COVID-19 Vaccines


